| Главная » Статьи » Основы охраны здоровья |
В настоящее время наиболее перспективным и быстроразвивающимся направлением медицины и фармакологии является персонализированная медицина. Открытия последних лет в области генетики, молекулярной биологии, биоинформатики и ряда других медико-биологических наук позволили по-новому взглянуть на механизмы взаимодействия между клетками, белками и генами человека. Люди различаются по своей молекулярно-генетической структуре, определяющей биохимические и иммунные процессы в организме, и соответственно лечить их надо с учетом их индивидуальных особенностей. Другими словами, к каждому человеку требуется индивидуальный подход. Это и есть сущность персональной медицины. Каждому больному – индивидуальное лечение на основе биологических особенностей его организма. Персонализированная медицина – это оказание комплексной медицинской помощи (профилактики, диагностики, лечения и реабилитации), осуществляемое в соответствии с характеристиками конкретного пациента. Этот термин учитывает не только используемые уже в течение долгого времени клинические признаки, например, возраст, пол, телосложение, социально-психологические факторы и другие, но, в первую очередь, генно-молекулярные характеристики организма пациента. Последние включают данные геномных и постгеномных исследований, в том числе протеомики[1] и метаболомики, выполненные при помощи современных высокотехнологичных методов молекулярной биологии и медицины. Одной из целей персонализированной медицины является разделение популяции здоровых и больных людей на отдельных индивидуумов и небольшие группы, отличающихся по вероятности возникновения заболевания и по способности реагировать на те или иные виды терапии, т.е. точнее выбирать пациентов и подгруппы пациентов с более высокой вероятностью ответа на лечение. Такая классификация позволит рационально и прицельно применять терапевтические средства с максимальной пользой и минимумом неблагоприятных эффектов для отдельного человека. Персонализированная медицина является быстро развивающейся областью науки и медицинской практики. По оценке глобальной консалтинговой компании PwC общий рынок товаров и услуг, связанных с персонализированной медициной, в США оценивается в 300-400 миллиарда долларов в год и будет расти дальше. Цель персонализированной медицины состоит в том, чтобы найти подходящее лекарство для конкретного больного и разработать схему лечения больного в соответствии с его генотипом. В более широком смысле персонализированная медицина представляет собой интегральную медицину, которая включает разработку персонализированных средств лечения на основе геномики[2], тестирование на предрасположенность к болезням, профилактику, объединение диагностики с лечением и мониторинг лечения. Будущее персонализированной медицины зависит от развития нанотехнологий и их экономической эффективности[3]. Мы стоим на пороге революции в медицине, включая современные методы диагностики и избирательного лечения. Нанотехнологии уже увеличили нашу способность выявлять первые признаки заболеваний, эффективнее и раньше диагностировать генетические предрасположенности к определенным заболеваниям. В результате диагностика станет очень точной и появится возможность выявлять заболевания, которые еще только могут возникнуть. Появятся сверхчувствительные диагностические нанотехнологии, которые выведут диагностику на новый уровень. Дело в том, что первые признаки заболевания проявляются в наномасштабах. Человеческое тело содержит около 100 триллионов живых клеток. Для того, чтобы взаимодействовать друг с другом, клетки обмениваются информацией. Информацию передают крошечные молекулы (фрагменты ДНК или белки), размеры которых всего несколько нанометров[4]. Цепочки химических реакций запускаются благодаря этим молекулярным «посредникам». Если клетка больна, она посылает различные сигналы. Биологи называют их биомаркерами[5]. Это молекулярные признаки заболевания, индикаторы, которые может использовать диагностическое оборудование на основе нанотехнологий. Существуют уникальные генетические белковые маркеры почти для каждого заболевания. За последнее десятилетие ученые научились идентифицировать эти маркеры. Сейчас разрабатываются тесты, которые позволяют быстро и достоверно определять биомаркеры, на их основе ставить диагноз, определять стадию заболевания, назначать индивидуальное лечение. Так, например, новые методы диагностики на основе революционных достижений геномики позволят выявлять предрасположенность к заболеваниям и определять вероятность рисков, проводить раннюю диагностику и профилактику заболевания, подбирать в соответствии с результатами фармакогеномного теста таргетные (избирательные) лекарственные средства и мониторировать ход лечения. С помощью новых методов (посредством выявления протеинов и молекул ДНК, которые синтезируются в клетках пораженных тканей) станет возможно определять риск возникновения и развития таких тяжелых заболеваний, как рак, атеросклероз и многих других социально значимых болезней. Значительную роль в диагностике болезней (in vivo и in vitro) сыграют медицинские нанотехнологии, развитие которых связано с совершенствованием методов молекулярной медицины. Уже сегодня на их основе разрабатывается множество диагностических тестов, включая биочипы. Биочип – микромножество либо матрица с нанесенными молекулами белков, нуклеиновых кислот, биомакромолекул или биоструктур для одновременного проведения большого числа анализов в одном образце; или электронное устройство, содержащее биологические молекулы. Биологические микрочипы широко используются в in vitro диагностике. В основе механизма действия биочипов лежит молекулярное распознавание анализируемых молекул молекулами-биополимерами, нанесенными на чип. Это распознавание построено либо на взаимодействии рецепторов с лигандами (например, антител с антигенами), либо на гибридизации комплементарных цепей ДНК. В частности, разработаны биочипы, распознающие короткие олигонуклеотидные последовательности и позволяющие детектировать единичные мутации в генах. Наноразмерная длина олигонуклеотидов, нанесенных на микрочип, является одним из ключевых факторов, определяющих их высокую эффективность и специфичность. На поверхности ДНК-чипа иммобилизованы олигонуклеотиды. При добавлении анализируемого образца комплементарная таргетная ДНК в образце формирует дуплекс с олигонуклеотидом на чипе. В результате генерируется сигнал, свидетельствующий о наличии в пробе соответствующего объекта (инфекции, онкомаркера и т.п.). Важнейшую роль персонализированная медицина играет при разработке и применении лекарственных средств. Несмотря на то, что применение лекарств в настоящее время основывается на принципах доказательной медицины, эффективность терапии составляет около 60%. По данным ВОЗ, в начале XXI века стандартная фармакотерапия не давала эффективного результата при лечении депрессий (20–40% больных), язвы желудка (20–70%), бронхиальной астмы (40–75%), сахарного диабета (5–75%), онкологии (70–100%), мигрени (30–60%), артериальной гипертензии (10–75%), шизофрении (25–75%). Растет число нежелательных лекарственных реакций, вплоть до смертельных исходов. Ученые установили, что при назначении стандартной дозы лекарственного средства у части больных их концентрация в крови становится слишком высокой – развиваются побочные явления, у других концентрация остается слишком низкой и лечение оказывается неэффективным. Разные люди реагируют на лекарственные средств по-разному. Соответственно лечить их надо по-разному. Ответ человеческого организма на лекарственное воздействие зависит от многих факторов. Это генетические особенности организма, а также пол, возраст, тяжесть основного засоления, наличие сопутствующих заболевания, особенно функционирования печени и почек, участвующих в метаболизме и выведении лекарственных средств, прием других лекарственных средств, особенности питание, прием алкоголя и т.д. Другими совами, действие лекарств зависит от особенностей метаболизма и нарушений выведения ЛС из организма, которые в свою очередь во многом определяются наследственными факторами. Все это свидетельствует о необходимости индивидуального (персонализированного) назначения медикаментов каждому пациенту. Таким образом, безопасность и эффективность лекарственных средств в процессе лечения больных во многом зависят от биологических особенностей каждого человека. Выявление этих особенностей посредством геномных и молекулярных исследований позволяет определить оптимальную комбинацию лекарств и уточнить рациональные дозы. Для этого проводят оценку ферментативных систем и фармакогенетическое тестирование. Определение фармакогенетических мишеней открывает пути к целевой (таргетной) терапии ряда заболеваний. Информация о генетическом профиле пациента позволит уменьшить число людей, страдающих от побочных эффектов при приеме лекарственных средств, и одновременно увеличить вероятность достижения максимального терапевтического эффекта. Универсальные методы и средства лечения должны стать скорее исключением, а не правилом. Так как реакция пациентов с одной и той же болезнью на одно и то же лекарство различается в зависимости от генотипа больного и других факторов, то возможны значительные колебания в эффективности и безопасности препарата, применяемого для лечения определенного заболевания. Достижения исследователей в области геномики позволяют говорить о том, что уже вскоре состояние пациентов будет описываться миллиардами различных параметров. Информация о вариантах генов, добавляемая к системам поддержки принятия клинических решений, может предотвратить отрицательную реакцию на лекарства. Нельзя забывать, что каждый дополнительный препарат, принимаемый пациентом, особенно пожилым, повышает вероятность отрицательной реакции на 14%, а 60% пожилых пациентов в США ежедневно принимают, по крайней мере, девять различных лекарств[6]. В историческом плане индивидуальный подход к ряду клинических вопросов был очевиден давно. Достаточно вспомнить опыт переливания крови до открытия групповой принадлежности, первые попытки трансплантации тканей и органов. Иначе говоря, персонализированная медицина не является чем-то новым. В известном смысле медицина всегда была персонализирована. Но только недавно мы научились заглядывать глубже – на молекулярный уровень. Типирование тканей на основе генетических маркеров применяется при подборе трансплантатов для конкретных реципиентов, а в некоторых способах лечения рака используются собственные опухолевые клетки пациента. В настоящее время концепция персонализации распространяется на фармацевтические препараты, которые когда-то считались универсальными средствами лечения конкретных болезней. Но сейчас становится ясно, что реакция пациентов с одной и той же болезнью на одно и то же лекарство различается в зависимости от генотипа больного и других факторов, так что возможны значительные колебания в эффективности и безопасности препарата, применяемого для лечения определенного заболевания. Современная база персонального подхода основывается на молекулярно-биологической диагностике и определении биомаркеров, ассоциированных с развитием и течением болезней. Полученные данные формируют генетический паспорт человека. Наличие такого паспорта создает оптимальные условия для определения риска возникновения заболевания (предсказательная или предиктивная медицина), персональной профилактики (превентивная или профилактическая медицина), а также доклинического диагноза. Значение предсказательной и профилактической медицины особенно велико при наследственных, онкологических, инфекционных, заболеваниях, при выборе лекарственной терапии и изучении безопасности и побочных действий лекарств (клиническая фармакогенетика). На сегодня персональная медицина ввиду ограниченных возможностей и высокой стоимости диагностических технологий представляется достаточно дорогой. Однако возможности растут, а стоимость технологий по мере их совершенствования и востребованности быстро снижается. В ближайшем будущем персональная медицина за счет своей общей эффективности и рационального подбора лекарств должна стать дешевле нынешней. В настоящее время накопилось достаточно свидетельств возможности применения фармакогеномики и фармакогенетики как основы персонализированной медицины. Имеются персонализированные средства лечения нескольких заболеваний. Знания, получаемые в рамках фармакогеномики и фармакогенетики, используются для существующих способов лечения и разработки новых медицинских средств для лечения конкретных групп заболеваний. Важные изменения, произошедшие в медицинской практике и связанные с внедрением концепций фармакогеномики и фармакогенетики, состоят в том, что врачи могут классифицировать пациентов не просто как поддающихся и не поддающихся лечению, а более точно – в соответствии с известными связями между генетическим профилем и эффективностью лекарства. Следовательно, нежелательные реакции на лекарственные препараты уже не рассматриваются как просто идиосинкразия. Персонализированная медицина, как она описана выше, не конфликтует с существующими тенденциями «медицины, основанной на доказательствах» (evidence-based medicine). Обоснованность назначения лечения в данном случае базируется на оценке вероятности достижения положительного результата и приемлемости возможных побочных эффектов с учетом ценностных установок самого больного. Таким образом, фармакогенетика и фармакогеномика будут способствовать индивидуализации лечения. Нет сомнений в том, что врачам всех специальностей необходимо смотреть в будущее, постепенно менять свой менталитет и начинать подготовку к переходу к предсказательно-предупредительной и профилактической персональной медицине.
Приложение к статье
СПРАВОЧНАЯ ИНФОРМАЦИЯ ПО ОСНОВАМ ГЕНЕТИКИ
В человеческом организме содержатся три основных вида органических макромолекул, определяющих его функционирование: 1) дезоксирибонуклеиновая кислота (ДНК); 2) рибонуклеиновая кислота (РНК); 3) белки (протеины, полипептиды).
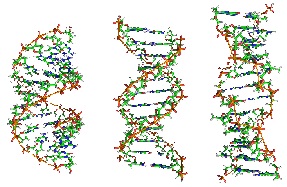
1. Дезоксирибонуклеиновая кислота (ДНК) Дезоксирибонуклеиновая кислота (ДНК) – макромолекула, обеспечивающая хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов. ДНК содержит информацию о структуре различных видов РНК и белков. У человека ДНК находится в ядре клетки[7] в составе хромосом[8], а также в некоторых клеточных органоидах (митохондриях и пластидах). С химической точки зрения ДНК – это длинная полимерная молекула, состоящая из повторяющихся блоков – нуклеотидов. Каждый нуклеотид состоит из азотистого основания, сахара (дезоксирибозы) и фосфатной группы. Связи между нуклеотидами в цепи образуются за счет дезоксирибозы и фосфатной группы (фосфодиэфирные связи). В подавляющем большинстве случаев (кроме некоторых вирусов, содержащих одноцепочечную ДНК) макромолекула ДНК состоит из двух цепей, ориентированных азотистыми основаниями друг к другу. Эта двухцепочечная молекула спирализована. В целом структура молекулы ДНК получила название «двойной спирали». В зависимости от концентрации ионов и нуклеотидного состава молекулы, двойная спираль ДНК в живых организмах существует в разных формах. На рисунке 1 представлены формы A, B и Z (слева направо).
Рисунок 1. Формы A, B и Z двойной спирали ДНК.
В ДНК встречается четыре вида азотистых оснований (аденин, гуанин, тимин и цитозин). Азотистые основания одной из цепей соединены с азотистыми основаниями другой цепи водородными связями согласно принципу комплементарности: аденин соединяется только с тимином, гуанин – только с цитозином. Последовательность нуклеотидов позволяет «кодировать» информацию о различных типах РНК, наиболее важными из которых являются информационные, или матричные (мРНК), рибосомальные (рРНК) и транспортные (тРНК). Все эти типы РНК синтезируются на матрице ДНК за счет копирования последовательности ДНК в последовательность РНК, синтезируемой в процессе транскрипции[9], и принимают участие в биосинтезе белков (процессе трансляции[10]). Помимо кодирующих последовательностей, ДНК клеток содержит последовательности, выполняющие регуляторные и структурные функции. Таким образом, ДНК является носителем генетической информации, записанной в виде последовательности нуклеотидов с помощью генетического кода. С молекулами ДНК связаны два основополагающих свойства живых организмов – наследственность и изменчивость. В ходе процесса, называемого репликацией[11] ДНК, образуются две копии исходной цепочки, наследуемые дочерними клетками при делении, таким образом образовавшиеся клетки оказываются генетически идентичны исходной. Генетическая информация реализуется при экспрессии генов[12] в процессах транскрипции (синтеза молекул РНК на матрице ДНК) и трансляции (синтеза белков на матрице РНК). Последовательность нуклеотидов «кодирует» информацию о различных типах РНК: информационных, или матричных (мРНК), рибосомальных (рРНК) и транспортных (тРНК). Все эти типы РНК синтезируются на основе ДНК в процессе транскрипции. Их роль в биосинтезе белков (процессе трансляции) различна. Информационная РНК содержит информацию о последовательности аминокислот в белке, рибосомальные РНК служат основой для рибосом (сложных нуклеопротеиновых комплексов, основная функция которых – сборка белка из отдельных аминокислот на основе иРНК), транспортные РНК доставляют аминокислоты к месту сборки белков – в активный центр рибосомы, «ползущей» по иРНК. Расшифровка структуры ДНК (
2. Рибонуклеиновая кислота (РНК) Рибонуклеиновая кислота (РНК) – одна из трех основных макромолекул (две другие – ДНК и белки), которые содержатся в клетках всех живых организмов. Так же, как ДНК, РНК состоит из длинной цепи, в которой каждое звено называется нуклеотидом. Каждый нуклеотид состоит из азотистого основания, сахара рибозы и фосфатной группы. Последовательность нуклеотидов позволяет РНК кодировать генетическую информацию. Все клеточные организмы используют РНК (мРНК) для программирования синтеза белков. Клеточные РНК образуются в ходе транскрипции, то есть синтеза РНК на матрице ДНК, осуществляемого специальными ферментами – РНК-полимеразами. Затем матричные РНК (мРНК) принимают участие в трансляции – синтезе белка на матрице мРНК при участии рибосом. Другие РНК после транскрипции подвергаются химическим модификациям, и после образования вторичной и третичной структур выполняют функции, зависящие от типа РНК. Для одноцепочечных РНК характерны разнообразные пространственные структуры, в которых часть нуклеотидов одной и той же цепи спарены между собой. Молекулы РНК входят в состав некоторых ферментов, у отдельных РНК обнаружена собственная ферментативная активность: способность вносить разрывы в другие молекулы РНК или, наоборот, «склеивать» два РНК-фрагмента. Такие РНК называются рибозимами. Способность молекул РНК одновременно служить как в качестве носителя информации, так и в качестве катализатора химических реакций, позволила выдвинуть гипотезу о том, что РНК была первым сложным полимером, появившимся в процессе добиологической эволюции.
3. Белки (протеины, полипептиды) Белки (протеины, полипептиды) – высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединенных в цепочку пептидной связью. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций создают молекулы белков с большим разнообразием свойств. Кроме того, аминокислотные остатки в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул разных белков образуют сложные комплексы, например, фотосинтетический комплекс. Функции белков в клетках живых организмов более разнообразны, чем функции других биополимеров – полисахаридов и ДНК. Так, белки-ферменты катализируют протекание биохимических реакций и играют важную роль в обмене веществ. Некоторые белки выполняют структурную или механическую функцию, образуя цитоскелет, поддерживающий форму клеток. Также белки играют ключевую роль в сигнальных системах клеток, при иммунном ответе и в клеточном цикле. Выделяют 4 уровня структурной организации белков: первичную, вторичную, третичную и четвертичную структуры. Хотя такое деление несколько устарело, им продолжают пользоваться. Первичная структура (последовательность аминокислотных остатков) полипептида определяется генетическим кодом, а структуры более высоких порядков формируются в процессе сворачивания белка. Хотя пространственная структура белка в целом определяется его аминокислотной последовательностью, она является довольно лабильной и может зависеть от внешних условий, поэтому более правильно говорить о предпочтительной или наиболее энергетически выгодной конформации белка.
Источник: журнал «Медицинская статистика и оргметодработа в учреждениях здравоохранения» N 3/2019.
[1] Протеомика - наука, изучающая белки, их функции и взаимодействия в живых организмах. Основная задача протеомики - количественный анализ экспрессии белков в клетках в зависимости от их типа, состояния или влияния внешних условий. Преимуществом протеомики перед геномикой является тот факт, что наличие какого-либо гена в геноме не означает, что с него производится транскрипция (процесс синтеза РНК с использованием ДНК в качестве матрицы), а наличие транскрипта (РНК) не означает, что с него происходит трансляция (процесс синтеза белка из аминокислот на матрице информационной (матричной) РНК), а даже если происходит, то транскрипт (РНК) не позволяет однозначно говорить о структуре белка, его созревании и локализации. [2] Геномика - раздел молекулярной генетики, посвященный изучению генома и генов живых организмов. Геном - совокупность наследственного материала, заключенного в клетке организма. Ген (др.-греч. γένος - род) - структурная и функциональная единица наследственности живых организмов. Ген представляет собой участок ДНК, задающий последовательность определенного полипептида либо функциональной РНК. [3] По мнению экспертов, стоимость использования ряда нанотехнологий в области медицины экспотенциально уменьшается, что напоминает закон Мура о росте производительности процессоров и уменьшении их стоимости на единицу мощности в компьютерной промышленности. В настоящее время аналогические тенденции наблюдаются в сфере медицинских нанотехнологий. [4] Нанометр – 10–9 метра. [5] Под биомаркером (молекулярным индикатором) понимают молекулу, наличие или отсутствие которой позволяет сделать вывод о протекании определенного клеточного процесса или определить тип клетки. В качестве биомаркера может выступать ген, последовательность генов, белок или другая макромолекула, морфологические, метаболические, физиологические или лабораторные характеристики. Например, нейропсихиатрический биомаркер — это валидный стандартизованный высокоспецифичный биологический признак, указывающий на наличие того или иного нейропсихиатрического заболевания (шизофрения, биполярное аффективное расстройство, депрессия, эпилепсия, болезнь Альцгеймера и других расстройств, связанные с нарушением функции нервной системы). [6] После того как в Великобритании проанализировали 305 тыс. выписанных в течение 8 лет рецептов пожилым людям, выяснилось, что при приеме 4-5 лекарств вероятность побочных эффектов вырастает в 35 раз. Это означает, что в дальнейшем такой больной обратится за медицинской помощью из-за развития побочных эффектов. [7] Ядро (лат. nucleus) - это один из структурных компонентов клетки, содержащий генетическую информацию (молекулы ДНК), осуществляющий функции хранения, передачи и реализации наследственной информации с обеспечением синтеза белка. В клеточном ядре происходит репликация (процесс синтеза дочерней молекулы ДНК на матрице родительской молекулы ДНК - в результате происходит удвоение молекул ДНК) и транскрипция (синтез молекул РНК на молекуле ДНК с использованием последней в качестве матрицы). Таким образом, ядро клетки является не только вместилищем генетической информации, но и местом, где этот материал функционирует и воспроизводится. [8] Хромосомы (др.-греч. χρῶμα - цвет и σῶμα - тело) - нуклеопротеидные структуры в ядре клетки, в которых сосредоточена большая часть наследственной информации и которые предназначены для её хранения, реализации и передачи. Хромосома образуется из единственной и чрезвычайно длинной молекулы ДНК, которая содержит линейную группу множества генов. Другими словами, под хромосомой понимают структуру, которая содержит нуклеиновую кислоту, функция которой состоит в хранении, реализации и передаче наследственной информации. [9] Транскрипция (от лат. transcriptio - переписывание) - процесс синтеза РНК с использованием ДНК в качестве матрицы, происходящий во всех живых клетках. Другими словами, это перенос генетической информации с ДНК на РНК. Транскрипция катализируется ферментом ДНК-зависимой РНК-полимеразой. [10] Трансляция (от лат. translatio - перевод) - процесс синтеза белка из аминокислот на матрице информационной (матричной) РНК, осуществляемый рибосомой. [11] Репликация (от лат. replicatio - возобновление) - процесс синтеза дочерней молекулы ДНК на матрице родительской молекулы ДНК. В ходе последующего деления материнской клетки каждая дочерняя клетка получает по одной копии молекулы ДНК, которая является идентичной ДНК исходной материнской клетки. Этот процесс обеспечивает точную передачу генетической информации из поколения в поколение. Репликацию ДНК осуществляет сложный ферментный комплекс, состоящий из 15-20 различных белков, называемый реплисомой. [12] Экспрессия генов — это процесс, в ходе которого наследственная информация от гена (последовательности нуклеотидов ДНК) преобразуется в функциональный продукт — РНК или белок. Экспрессия генов может регулироваться на всех стадиях процесса: и во время транскрипции, и во время трансляции, и на стадии посттрансляционных модификаций белков. Регуляция экспрессии генов позволяет клеткам контролировать собственную структуру и функцию и является основой дифференцировки клеток, морфогенеза и адаптации. Время, место и количественные характеристики экспрессии одного гена могут иметь влияние на функции других генов. | |
| Категория: Основы охраны здоровья | Добавил: zdrav1 (25.02.2020) | |
| Просмотров: 1728 |
| Всего комментариев: 0 | |