| Главная » Статьи » Методические материалы |
Эффективность системы здравоохранения во многом определяется эффективностью применяемых медицинских технологий. Это аксиома. Чтобы выбрать эффективные технологии нужно провести их объективную оценку. Для этого разработаны соответствующие методики. Клинические и управленческие решения в здравоохранении должны основываться на научных принципах доказательной медицины и доказанных в ходе исследований фактах и причинно-следственных связях в количественном выражении. Именно они должны лежать в основе определения политики и принятия управленческих решений в области здравоохранения. Именно на них должны основываться клинические рекомендации, протоколы лечения, стандарты и порядки оказания медицинской помощи, лежащие в основе деятельности руководителей и рядовых работников медицинских организаций. Повышение качества оценки медицинских технологий – это первый этап и важнейшая составляющая перспективного планирования здравоохранения. Следующим этапом является внедрение (на основе широкого тиражирования) современных эффективных медицинских технологий, от которых зависит качество и доступность медицинской помощи населению. В связи с актуальностью и значимостью проблемы оценки медицинских технологий редакция журнала подготовила серию статьей по организации и проведению оценки медицинских технологий. Это тот минимум, который в обязательном порядке должны знать организаторы здравоохранения. Представленный материал также незаменим для медицинских работников, занимающихся научной деятельностью. Серия статей будет состоять из следующих публикаций: 1. Организация оценки медицинских технологий (то, что Вы читаете сейчас); 2. Методика оценки медицинских технологий (часть 1); 3. Методика оценки медицинских технологий (часть 2); 4. Методики проведения ABC-, VEN-, частотного и DDD-анализов.
Организация оценки медицинских технологий Для того чтобы принять решение о внедрении новых медицинских технологий в практическое здравоохранение, необходимо провести объективную оценку их эффективности и результативности. Для этого разработан ГОСТ Р 56044-2014 «Оценка медицинских технологий. Общие положения»[1]. Указанный стандарт устанавливает общие положения оценки медицинских технологий и предназначен для применения в системе здравоохранения Российской Федерации. Для клинико-экономической оценки медицинских технологий используется ГОСТ Р 57525-2017 «Клинико-экономические исследования. Общие требования»[2], хотя описание и общие положения клинико-экономического анализа даны и в ГОСТ Р 56044-2014. Оценка медицинских технологий и основанные на ней рекомендации используются следующими группами лиц, принимающих решения: - плательщиками (страховые медицинские организации, фонды обязательного медицинского страхования, распорядители бюджета в области здравоохранения, пациенты) в отношении обоснованности затрат на медицинские технологии; - клиницистами и пациентами относительно целесообразности применения медицинской технологии; - руководителями медицинских организаций относительно внедрения новых медицинских технологий или замены существующих; - представителями фармацевтической и медицинской промышленности при разработке новых медицинских технологий и маркетинге; - органами законодательной и исполнительной власти (при определении политики и принятии стратегических решений в области здравоохранения); - инвесторами при финансировании новых проектов в области здравоохранения. Акценты при оценке медицинских технологий могут быть расставлены по-разному в зависимости от интересов заинтересованных лиц, соответственно при этом будут использованы разные критерии оценки. Например, регулирующие органы, ответственные за регистрацию новой медицинской технологии и ее дальнейший мониторинг, заинтересованы, в первую очередь, в действенности и безопасности медицинских технологий. Плательщики за медицинскую помощь обратят внимание на стоимость и экономическую эффективность технологий, а медицинские организации и потребители – на эффективность, безопасность, законность, этичность, стоимость, удобство использования и т.д. (тут могут быть самые разные мнения и оценки с различных точек зрения и соответственно различное ранжирование по значимости) Принятие эффективных решений должно базироваться на научных математических, логических и экономических моделях (теория игр, древо решений, модель Маркова и др.). Общим для использования всех моделей при принятии решений является применение правила квадрата принятия решений (см. приложение к настоящей статье). Правило квадрата принятия решения – лицо, принимающее решение, оказывается как бы в туннеле квадратного сечения, где на него воздействует несколько факторов – граней. Первая грань – информационная – получение релевантной информации из общего объема информации. Далее эта информация подвергается осмыслению, и на этой основе строится первичная модель решения (грань анализа и моделирования). На эту модель существенное влияние оказывают неспецифические факторы, образуя грань неспецифических воздействий. Всякая экономическая система пытается остаться в стабильном состоянии и сопротивляется любым изменениям и воздействиям, образуя грань сопротивления на уровне субъектно-объектных отношений. Процедура оценки медицинских технологий является элементом двух первых граней квадрата принятия решения. Таким образом, оценка медицинской технологии – это всесторонний процесс обобщения информации о медицинской технологии, направленный на оптимизацию принятия решений, при котором изучаются краткосрочные и отсроченные медицинские, социальные, экономические и этические аспекты разработки, распространения и применения медицинской технологии, проводимый с использованием открытых, непредвзятых, систематических и устойчивых процедур.
Основные термины и определения МЕДИЦИНСКИЕ ТЕХНОЛОГИИ – методы диагностики, лекарственного и нелекарственного лечения, профилактики и реабилитации, системы охраны и укрепления здоровья, использующиеся в здравоохранении. К медицинским технологиям относят: - применение лекарств, включая биологические препараты (вакцины, сыворотки, препараты биотехнологического производства) при определенном заболевании, синдроме или клинической ситуации; - применение крови и ее компонентов при определенном заболевании, синдроме или клинической ситуации; - применение специализированного лечебного питания; - использование приборов (компьютерный томограф, аппарат для измерения артериального давления), расходных материалов, (перчатки, бинты), технических устройств и приложений к мобильным телефонам и мини-компьютерам (фотофиксация, оценка энергетической ценности продуктов питания по специальному коду, шагомер и др.); - терапевтические и хирургические процедуры (акупунктура, плазмаферез, эндоскопическая цистэктомия, методы психологического воздействия); - иные мероприятия и процедуры (школа пациента с определенной патологией, обучение родственников и немедицинских работников процедурам ухода, дистанционные консультации с использованием телекоммуникативных систем и приспособлений); - вспомогательные управленческие системы и процедуры (использование формуляра больницы, аутсорсинг лабораторных исследований, лицензирование деятельности организаций, система электронной или телефонной записи на приеме к врачу, применение электронной истории болезни); - системы организации, предоставления и управления медицинской помощью (программа диспансеризации, программа иммунизации, система оплаты из средств обязательного медицинского страхования за пролеченного больного, система фондодержания врачом общей практики). ОБЪЕКТ ОЦЕНКИ МЕДИЦИНСКОЙ ТЕХНОЛОГИИ – медицинские технологии, разрешенные к применению в системе здравоохранения Российской Федерации в установленном порядке, находящиеся в процессе официальной регистрации, применяемые в международной практике или практике других стран. ПРЕДМЕТ ОЦЕНКИ МЕДИЦИНСКОЙ ТЕХНОЛОГИИ – данные о действенности, эффективности, безопасности и экономической целесообразности (приемлемости), этичности и законности медицинской технологии в конкретной ситуации (применение технологии в конкретной группе больных или населения по конкретным показаниям конкретным способом). Могут быть оценены другие данные, например, о биологической или терапевтической эквивалентности воспроизведенного и оригинального лекарственных средств или о терапевтической эквивалентности биологически произведенных лекарств и т.д. ДЕЙСТВЕННОСТЬ МЕДИЦИНСКОЙ ТЕХНОЛОГИИ – эффекты от применения медицинской технологии, полученные в условиях контролируемых клинических исследований. ЭФФЕКТИВНОСТЬ МЕДИЦИНСКОЙ ТЕХНОЛОГИИ – эффекты от применения медицинской технологии, полученные в условиях типичной клинической практики (реального мира). БЕЗОПАСНОСТЬ МЕДИЦИНСКОЙ ТЕХНОЛОГИИ – степень риска развития нежелательных побочных реакций и побочных эффектов. ЭКОНОМИЧНОСТЬ МЕДИЦИНСКОЙ ТЕХНОЛОГИИ – приемлемое для плательщика соотношение затрат на медицинскую технологию и результатов ее применения. ЭТИЧНОСТЬ И ЗАКОННОСТЬ МЕДИЦИНСКОЙ ТЕХНОЛОГИИ – непротиворечие применения медицинской технологии этическим нормам, сложившимся в обществе (включая религиозные аспекты) и действующему законодательству.
Цели и задачи оценки медицинских технологий Оценку медицинских технологий проводят в целях повышения качества и доступности медицинской помощи путем обеспечения неопределенного круга лиц или представителей целевой группы (лиц, принимающих решение, медицинских работников, пациентов или соответствующих организаций) объективной, обобщенной, систематизированной информацией о действенности, эффективности, безопасности, экономичности, этичности и законности методов диагностики, лечения, профилактики и реабилитации с учетом доказательной базы, этических, юридических, социальных и экономических аспектов применения медицинской технологии. Для оценки разработан вышеупомянутый ГОСТ Р 56044-2014 «Оценка медицинских технологий. Общие положения». Основной его целью является унификация требований к проведению оценки медицинских технологий. Задачами стандарта являются: - оптимизация и нормативное обеспечение процесса оценки медицинских технологий; - создание условий для выработки правильных, научно обоснованных, оптимальных политических, организационных и экономических решений о внедрении отдельных медицинских технологий в практику на федеральном, региональном и локальном уровнях системы здравоохранения, разработки документов, регулирующих объемы и качество медицинской помощи [клинические рекомендации (протоколы лечения), стандарты медицинской помощи, перечни и формуляры лекарственных средств и др.]; - обоснование решений о финансировании медицинских технологий за счет обобществленных источников (обязательное медицинское страхование, федеральный бюджет, бюджеты субъектов федерации, добровольное медицинское страхование и т.д.) или личных средств граждан; - планирование научных исследований в сфере здравоохранения; - выбор оптимального метода диагностики, лечения, профилактики и реабилитации при ведении определенных групп пациентов и конкретных больных.
Организация оценки медицинских технологий
Кто оценивает медицинские технологии? Для проведения оценки медицинских технологий создается орган по оценке медицинских технологий, который может быть создан на временной или постоянной основе: - органами законодательной и исполнительной власти, включая органы управления здравоохранения любого уровня; - фондом обязательного медицинского страхования; - страховой медицинской организацией; - медицинской организацией; - научно-исследовательской медицинской организацией; - образовательной медицинской организацией; - профессиональной медицинской общественной организацией; - общественной организацией пациентов. При создании органа по оценке медицинской технологии издается соответствующий распорядительный документ, содержащий основные положения об органе: цели и задачи его деятельности, полномочия, основные правила и регламент деятельности, правила делопроизводства и хранения информации, источники финансирования и т.д. Рекомендуется междисциплинарный состав органа по оценке медицинских технологий (включение в процесс оценки специалистов различных направлений), обеспечивающий объективность оценки, учет мнений различных заинтересованных и профессиональных сторон и целевых групп. Возглавляет орган по оценке медицинских технологий руководитель, назначаемый распорядительным документом организации, создавшей орган. Руководитель органа должен обладать опытом управления работой команды, желательно знанием английского языка, умениями поиска и критической оценки медицинской информации, быть знакомым с основными положениями медицины доказательств (клинической эпидемиологии), клинико-экономического анализа, оценки медицинских технологий, стандартизации медицинских технологий, иметь опыт работы по оценке медицинских технологий и соответствующие публикации. Функциями органа по оценке медицинских технологий являются: - планирование работ по оценке медицинских технологий (сбор и анализ предложений по проведению оценки конкретных медицинских технологий, выбор приоритетных технологий для оценки); - создание рабочих групп по оценке отдельных медицинских технологий, координация их работ и обеспечение их деятельности (канцелярские принадлежности, оргтехника, связь); - заслушивание и принятие отчетов рабочих групп; - направление отчетов рабочих групп на публикацию, определение сайта Интернет и печатного органа (периодическое издание), где будет освещаться деятельность рабочей группы, или выбор иной методики публичного распространения информации о результатах оценки медицинской технологии, например, для ограниченного круга лиц – сотрудников медицинской организации, если оценка медицинской технологии проводится для нужд медицинской организации; - организация обучения экспертов, участвующих в оценке медицинских технологий, консультирование по вопросам методологии оценки медицинских технологий; - анализ результатов работ по оценке медицинских технологий, разработка и внедрение рекомендаций по их совершенствованию.
Рабочая группа по оценке медицинской технологии Для проведения оценки отдельной медицинской технологии органом по оценке медицинских технологий формируется рабочая группа. Цели, задачи, порядок деятельности рабочей группы формулируются в Положении о деятельности рабочей группы. Членами рабочей группы по оценке медицинских технологий могут быть (в зависимости от задач оценки медицинских технологий) врачи различных специальностей, специалисты в области организации здравоохранения и общественного здоровья, средний медицинский персонал, провизоры, представители общественных организаций пациентов, экономисты, социальные работники, представители производителей лекарственных средств и изделий медицинского назначения, юристы, специалисты по медицинской этике и праву, в отдельных случаях – представители религиозных конфессий. Например, возможно участие юристов в процессе оценки медицинской технологии (ОМТ) на стадии рецензирования отчета на предмет экспертизы соответствия рекомендаций по применению технологии правам пациентов, или привлечение экономистов к расчету затрат на применение медицинской технологии, или приглашение представителей общественных объединений пациентов для обсуждения проекта рекомендаций по применению технологии, предназначенных для пациентов. В состав рабочей группы могут быть включены как члены органа по оценке медицинских технологий, так и иные эксперты, рекомендуемые членами органа или членами рабочей группы. Никто не вправе отказать во включении в состав рабочей группы новому члену, рекомендованному в порядке, установленном регламентом деятельности органа. Руководитель органа по оценке медицинских технологий назначает руководителя и секретаря рабочей группы. Руководитель рабочей группы должен обладать навыками группового управления (управления работой команды), поиска и критической оценки медицинской информации, быть знакомым с основными положениями медицины доказательств (клинической эпидемиологии), клинико-экономического анализа, оценки медицинских технологий, желательно иметь опыт работы по оценке медицинских технологий. Руководитель рабочей группы осуществляет координацию работ по оценке медицинской технологии, обеспечивает соблюдение методологических принципов оценки медицинских технологий, ведет заседания рабочей группы, если они предусмотрены регламентом. Секретарь рабочей группы осуществляет делопроизводство и обеспечивает взаимодействие членов рабочей группы, в том числе посредством Интернет. Члены рабочей группы должны быть знакомы с принципами медицины доказательств (клинической эпидемиологии), клинико-экономического анализа, желательно обладать навыками поиска и критической оценки медицинской информации. При необходимости члены рабочей группы должны пройти соответствующее обучение. Возможно привлечение к участию в процессе оценки медицинской технологии экспертов, не входящих в состав рабочей группы. Функции привлеченных к процессу оценки лиц определяются в установочном документе (положении о деятельности рабочей группы). Такими функциями могут быть предоставление дополнительной информации о медицинской технологии, рассмотрение проекта отчета, оценка правильности расчетов и построения моделей, формирование электронных таблиц, баз данных или математических моделей. На первом заседании рабочей группы формируется план работы, распределяются обязанности между членами рабочей группы.
Декларация конфликта интересов Члены органа по оценке медицинских технологий и рабочей группы по оценке медицинской технологии, привлекаемые к работе группы эксперты должны избегать конфликта интересов – наличия интересов, противоречащих общественным интересам, которые могут привести к заключениям, не отвечающим интересам пациентов, групп пациентов, системы здравоохранения, общества в целом. Основные положения и требования по учету конфликта интересов при формировании рабочей группы (комиссии) приведены в приложении Б к ГОСТ Р 56044-2014.
Порядок оценки медицинской технологии
Этапы оценки медицинской технологии Оценка медицинской технологии включает следующие этапы: - выбор темы для оценки; - формирование плана (протокола) оценки медицинской технологии; - формулировка вопросов для оценки; - поиск информации о медицинской технологии [эффективности, безопасности, экономической целесообразности (приемлемости), других характеристиках]; - формирование перечня медицинских технологий, альтернативных оцениваемой медицинской технологии, применяемых для достижения аналогичных целей, и обоснование выбора альтернативных технологий; - сведение полученных данных в структурированную форму, проведение расчетов, при необходимости; - критический анализ информации о медицинской технологии: эффективности, безопасности, экономической целесообразности (приемлемости), других характеристик, результатов применения в практике (типичная практика), доступности, социальной значимости и пр. (первая версия отчета), анализ альтернативных медицинских технологий (если имеются); - распространение первой версии отчета среди членов рабочей группы, или, при необходимости, среди приглашенных экспертов или внешних рецензентов; - обсуждение и валидация полученных материалов рабочей группой, формулирование заключительных рекомендаций, предложения по созданию окончательной версии отчета; - подготовка отчета (окончательная версия); - вынесение окончательной версии отчета на заседание органа по оценке медицинских технологий, внесение поправок в окончательную версию отчета (при необходимости); - публикация окончательной версии отчета. Заключительный отчет должен содержать следующие характеристики оцениваемой медицинской технологии: - описание проблемы: заболевание, группа заболеваний, синдром или симптом, на который направлена оцениваемая технология, эпидемиологические данные, бремя болезни, традиционное применение медицинских технологий, альтернативных оцениваемой технологии; - описание и характеристики оцениваемой медицинской технологии, преимущества и недостатки, методика применения технологии, критерии оценки эффективности и безопасности; раздел может содержать иллюстративный материал, формулы, модели; - эффективность в условиях экспериментальных исследований и клинической (типичной) практики; - безопасность – характеристика и частота побочных эффектов и нежелательных результатов при применении медицинской технологии, возможные пути предупреждения или уменьшения степени выраженности побочных эффектов; - экономическая (клинико-экономическая) оценка с расчетом соотношения затрат и эффективности (полезности), влияния на бюджет; - этическая характеристика с учетом норм морали, вопросы обеспечения справедливости в доступности технологии, возможность ущемления потребностей иных, не связанных с оцениваемой технологией социальных групп или нанесение вреда [например, тестирование школьников на применение наркотиков может иметь отрицательное значение даже в случае, если школьник (или его родители) не дают согласие на тестирование]; - организационные подходы по применению технологии, включая необходимость обучения персонала, создания специализированных отделений или кабинетов и т.д.; - социальные аспекты применения технологии с позиций различных социальных групп, выбор которых определяется особенностями оцениваемой технологии; - правовые аспекты, соответствие нормам права, в том числе обеспечение прав человека и конфиденциальности при применении технологии; - краткие характеристики медицинских технологий, альтернативных оцениваемой медицинской технологии; - нерешенные в ходе оценки технологии вопросы. Повторное рассмотрение вновь появившейся информации, актуализацию отчета и новую публикацию проводят с соблюдением изложенных выше этапов работы. Причиной для повторной оценки медицинской технологии может быть результат мониторинга ее внедрения, появление новых сведений об эффективности медицинских технологий, альтернативных оцениваемой медицинской технологии.
Выбор темы оценки медицинской технологии При выборе тем для оценки медицинской технологии рекомендуется учитывать следующие характеристики медицинских технологий: - социальная, медицинская и экономическая значимость заболевания, синдрома или клинической ситуации, при которых применяется обсуждаемая медицинская технология (первичная заболеваемость, распространенность, тяжесть заболевания, темп роста заболеваемости, инвалидизация, влияние на качество жизни, влияние на продолжительность жизни, ресурсоемкость, бремя болезни, затратность технологии и ее влияние на бюджет, обеспечение принципа справедливости в доступности оцениваемой и альтернативных медицинских технологий и пр.); - предполагаемое влияние технологии на течение и исходы заболевания, синдрома или клинической ситуации, при которых она применяется; - наличие разногласий между специалистами, администраторами, законодателями, плательщиками, потребителями и др. целевыми группами в отношении целесообразности применения технологии; - наличие альтернативных технологий, которые могут быть использованы при данном заболевании, синдроме или клинической ситуации; - возможность влияния на использование технологии управленческими методами; - наличие ресурсной базы для использования медицинской технологии – здания и сооружения, разрешенные к применению оборудование, средства медицинского применения, реактивы, лекарственные средства, персонал, имеющий соответствующую квалификацию (при необходимости); - этические и юридические аспекты (при необходимости); - заинтересованность лиц, принимающих решения в оценке конкретной медицинской технологии; - выполнимость оценки медицинской технологии, наличие необходимой доказательной базы. Орган по оценке медицинских технологий рассматривает все предложения по выбору темы и формирует, при необходимости, приоритетный перечень медицинских технологий, подлежащих оценке.
План (протокол) оценки медицинской технологии До начала работы рабочая группа формирует план (протокол) по оценке медицинских технологий, в котором должны быть отражены следующие вопросы: - наименование технологии, которая будет оцениваться; - обоснование выбора темы по оценке данной технологии; - цели и задачи оценки медицинской технологии; - этапы работы и сроки завершения каждого этапа; - характеристики медицинской технологии, которые подлежат оценке [эффективность, безопасность, экономическая целесообразность (приемлемость), другое]; - стратегия поиска данных о технологии, предполагаемые источники релевантной информации о медицинской технологии, ключевые слова, по которым будет осуществляться поиск релевантной информации; - критерии оценки доказательств эффективности, безопасности, экономической целесообразности (приемлемости) медицинской технологии; - принципы обобщения данных; - состав рабочей группы; - декларация конфликта интересов; - почтовый и электронный адрес для переписки; - источник финансирования работ.
Источники информации Источники информации о медицинской технологии подразделяют на первичные и вторичные. Первичным источником является публикация результатов клинических исследований, в том числе – регистров пациентов. Вторичными источниками информации о медицинской технологии являются обобщающие источники: инструкции по применению лекарственных средств и изделий медицинского назначения, формулярные статьи на лекарственные средства, обзор литературы, систематический обзор, мета-анализ, протоколы ведения больных, клинические рекомендации (протоколы лечения) и др. Поиск релевантной информации проводят в сети Интернет, в электронных базах данных, базах данных систематических обзоров и отчетов по оценке медицинских технологий, поиск вручную – в периодических изданиях, материалах конференций. Обязательным является проведение поиска в базе данных контролируемых испытаний Кокрановского сотрудничества, базе данных "Российская медицина" Центральной научной медицинской библиотеки Первого МГМУ им. И.М.Сеченова, Кокрановской библиотеке и базе данных MEDLINE. Другие базы данных для поиска определяются рабочей группой исходя из медицинской технологии, являющейся предметом оценки. В качестве дополнительных источников данных могут выступать данные регистра пациентов, обобщение формализованных наблюдений из медицинской практики, сообщения и отчеты о частоте побочных эффектов, данные о медицинской технологии, которые могут быть предоставлены изготовителями лекарственных средств, изделий медицинского назначения, провайдером медицинской технологии, медицинскими работниками, объединениями медицинских работников, объединениями пациентов, другие материалы, в которых содержится информация о результатах применения медицинской технологии, в том числе неопубликованные. Экспертам рабочей группы следует предпринимать специальные усилия и стремиться найти результаты неопубликованных исследований, так как существует тенденция преимущественной публикации положительных результатов. Информация о наличии неопубликованных исследований может быть получена, в частности, при анализе соответствия перечня начатых клинических исследований, зарегистрированных в специализированной базе данных, перечню публикаций, обнаруженных в результате поиска. Перечень всех найденных источников релевантной информации должен быть представлен в отчете с указанием выходных данных в соответствии с правилами публикации научной информации. При оценке альтернативных медицинских технологий следует учитывать возможное использование технологий не в соответствии с зарегистрированными показаниями (в первую очередь это касается лекарственных средств), наличие различий в показаниях, противопоказаниях, предупреждениях у различных изготовителей аналогичных лекарственных средств (генерических форм). Необходимы выявление этих данных в источниках и их фиксация.
Требования к поиску релевантной информации Поиск релевантной информации следует проводить таким образом, чтобы было обеспечено максимально полное обнаружение материалов, посвященных медицинской технологии, являющейся предметом оценки. Поиск релевантной информации проводят в два этапа. На первом этапе устанавливают ключевые слова и временные рамки проведения поиска. Ключевыми словами для проведения поиска являются: - наименование медицинской технологии; - наименование заболевания, синдрома, клинической ситуации, основных симптомов, на которые направлена медицинская технология; - соответствующие рубрики поисковой системы используемой базы данных; - наименования технологий сравнения; - наименования методов получения данных; - структура (дизайн) исследования; - другие термины и понятия по решению рабочей группы. Для обеспечения полноты выборки информации могут использоваться ключевые слова в комбинации и различные последовательности в ключевых словах (например, "клинический анализ крови", "анализ крови клинический", "общий анализ крови"), имеющие одинаковый смысл. Обязательно использование ключевых слов на русском и английском языках, желательно – на других языках, на которых часто проводятся публикации (испанский, немецкий, французский, итальянский). Временные рамки проведения поиска (глубина поиска – дата, с которой начинают изучение источников информации) определяет рабочая группа, исходя из сведений о времени появления медицинской технологии или альтернативной медицинской технологии, являющейся технологией сравнения. Ограничение поиска на первом этапе по каким-либо критериям должно быть обосновано в отчете. Например, глубина поиска с Не следует ограничивать поиск по таким критериям, как страна проведения исследования (наблюдения) или отсутствие публикации. Второй этап поиска начинают с оценки релевантности полученной информации. Из первичного множества источников информации выбирают содержащие непосредственное отношение к выбранной теме оценки медицинской технологии. Релевантность, в частности, определяется позицией (углом зрения) органа (рабочей группы) или заказчика оценки медицинской информации. Угол зрения при оценке медицинской технологии может существенно влиять на выбор релевантной информации для проведения оценки. По результатам анализа релевантности информации составляют таблицу, в которую должны быть сведены все найденные материалы об оцениваемой медицинской технологии. Для удобства дальнейшей работы по оценке медицинской технологии все источники релевантной информации компонуют по блокам оценки: - эпидемиология; - действенность; - эффективность; - безопасность; - экономичность; - законность и этичность; - социальная значимость; - бремя для бюджета и др. При этом в разных блоках источники информации могут повторяться. В случае отсутствия информации в отдельных блоках следует провести повторный поиск релевантной информации путем прицельного общения с потенциальными носителями информации – организациями-изготовителями, организациями-провайдерами, обществами пациентов, отдельными научными и практическими медицинскими экспертами и т.д.
Приложение
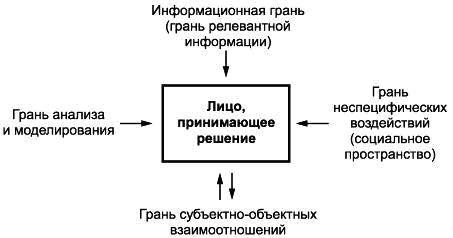
ПРИНЯТИЕ РЕШЕНИЙ О ВЫБОРЕ МЕДИЦИНСКИХ ТЕХНОЛОГИЙ НА ОСНОВАНИИ ПРАВИЛА "КВАДРАТА"
Правило подразумевает, что лицо, принимающее решение, испытывает воздействие нескольких различно направленных, иногда взаимоисключающих факторов, условно находясь внутри геометрической фигуры. Эта фигура состоит из четырех граней, образующих в проекции квадрат принятия решения: информационная грань (грань релевантной информации), грань анализа и моделирования, грань неспецифических воздействий, грань субъектно-объектных взаимоотношений (см. рисунок 1). Правило подразумевает несколько последовательных этапов, позволяющих принимать управленческие решения: - первый этап включает поиск релевантной информации (relevant – относящийся к делу), основа принятия решения – информационная грань; - второй этап представляет собой научный анализ информации, построение моделей – грань анализа и моделирования; - третий этап – анализ среды принятия решений – грань неспецифических воздействий (социальное пространство). Условия принятия решения – определенности (лица, принимающие решения, в точности знают результат каждого из альтернативных вариантов выбора), риска (решения, результаты которых не являются определенными, но вероятность каждого результата известна) и неопределенности (невозможно оценить вероятность потенциальных результатов); - четвертый этап заключается в установлении обратной связи – грань субъектно-объектных взаимоотношений. Прогнозирование, измерение и оценка последствий решения или сопоставление фактических результатов с теми, которые лица, принимающие решение, надеялись получить. Устанавливаются возможные ограничения для принятия решений.
Рисунок 1 – Правило принятия решения по выбору медицинских технологий
----------------------------------------- Публикация актуальна на 04.06.2019 (дата последней сверки). Источник публикации: журнал «Главный врач». Код публикации: 18.07.
[1] Утвержден и введен в действие приказом Федерального агентства по техническому регулированию и метрологии Российской Федерации от 11.06.2014 N 568-ст. Текст стандарта можно скачать с сайта редакции http://управление-здравоохранением.рф (раздел «Документы», подраздел «Методические материалы»). [2] Утвержден и введен в действие с 1 июня 2018 года приказом Росстандарта от 06.07.2017 N 655-ст. До этого действовал отраслевой стандарт "Клинико-экономические исследования. Общие положения" (ОСТ 91500.14.0001-2002), утвержденный приказом Минздрава РФ от 27.05.2002 N 163. В новый ГОСТ вошли основные положения старого ОСТа с учетом появившихся за последнее время инноваций в области клинико-экономических исследований. Текст стандарта можно скачать с сайта редакции http://управление-здравоохранением.рф (раздел «Документы», подраздел «Методические материалы»). | |
| Категория: Методические материалы | Добавил: zdrav1 (05.06.2019) | |
| Просмотров: 2196 |
| Всего комментариев: 0 | |