| Главная » Статьи » Методические материалы |
Обобщение информации о медицинской технологии По результатам анализа научных исследований действенности, эффективности, безопасности экономической целесообразности медицинской технологии составляют сводную таблицу, в которую вносят результаты анализа всех проанализированных исследований. В таблицу включают следующие данные: - библиографическая ссылка; - анализируемые медицинские технологии и технологии сравнения; - способ построения (структура, дизайн) исследования; - объем исследования (число включенных больных); - уровень методического качества исследования; - оцениваемые результаты; - величина эффекта; - осложнения при применении медицинской технологии; - метод клинико-экономического анализа; - виды учтенных затрат, размер затрат, анализ затрат (при необходимости); - значение показателей соотношения затрат и эффекта, приращения эффективности затрат; - статистическая значимость полученного эффекта; - заключение и выводы авторов исследования; - комментарии экспертов рабочей группы (особенности исследования, влияющие на достоверность результатов). Экспертами могут быть внесены в таблицы дополнительные разделы. Возможно составление нескольких таблиц, содержащих различные данные об исследованиях разного типа. Например, при наличии нескольких клинико-экономических исследований, в одних из которых использовали анализ стоимости болезни, а в других – "затраты-эффективность" и "затраты-полезность", целесообразно сводить исследования разных типов в разные таблицы. При рассмотрении сводных таблиц следует исследовать степень совпадения результатов, полученных при различных исследованиях. Если имеются противоречия в результатах различных исследований, экспертам – членам рабочей группы следует проанализировать их причины. При расхождении данных, полученных в исследованиях разных типов, предпочтение следует отдавать данным с низкой вероятностью систематической ошибки. На заседании рабочей группы обсуждаются результаты обобщения научных исследований эффективности, безопасности и экономической приемлемости медицинской технологии, а также дополнительные данные, представленные рабочей группе на рассмотрение или обнаруженные в ходе поиска (отчеты о нежелательных явлениях при применении медицинских технологий, опросы пациентов, экспертные заключения медицинских работников, этические и социальные аспекты применения технологи и пр.).
Особенности анализа результатов клинических исследований
Анализ описания случаев и серии случаев Описание случаев позволяет получить информацию о редких событиях (редких заболеваниях, нежелательных явлениях, связанных с применением медицинских технологий), необычных проявлениях болезней, сформулировать гипотезы о патогенезе заболеваний и возможных способах их лечения. Серии случаев дают возможность описать клиническую картину заболевания, оценить результаты оказания помощи в условиях типичной практики (реального мира). Однако отсутствие группы сравнения в исследованиях подобного дизайна и наличие множества вмешивающихся факторов, как правило, не позволяют делать заключения о наличии причинно-следственных связей между применением конкретных медицинских технологий и результатами. В связи с этим исследования случаев и серии случаев могут быть использованы для оценки эффективности медицинской технологии только при отсутствии исследований более высокого уровня доказательности. Исключением является ситуация, когда в серии случаев выявлен эффект применения медицинской технологии настолько значительный, что искажение результатов под влиянием случайной и систематической ошибки практически исключено. Например, летальность при хроническом миелолейкозе до появления новой медицинской технологии (антитирозинкиназной терапии) была высокой, близкой к 100%, а после внедрения технологии более 50% пациентов выживают.
Анализ исследований "случай-контроль" В исследовании должно быть обозначено, как проводился отбор участников исследования в основную и контрольную группы. Критерии включения и исключения должны быть одинаковы в основной и контрольной группах, за исключением наличия исследуемого исхода. Методы и критерии формирования групп случаев и контроля должны быть подробно описаны. Метод отбора участников в группу случаев должен быть надежным для выявления исследуемого исхода. Эксперты, проводящие оценку медицинской технологии, должны быть уверены в том, что у всех участников в группе случаев действительно имелся исследуемый результат. Вместе с тем группа должна быть репрезентативной (социально-демографические и клинические характеристики участников должны быть аналогичными характеристикам популяции, на которую будут экстраполированы результаты исследований). Одновременно необходимо убедиться, что в исследовании были использованы надежные методы, позволяющие исключить наличие исследуемого результата у участников в группе контроля. Группа контроля также должна быть репрезентативной. Должны быть описаны методы выявления причинного фактора. Для исследований "случай-контроль" характерна ошибка "памяти", в связи с чем методы выявления причинного фактора должны быть достаточно надежными, чтобы минимизировать эту ошибку. При выявлении наличия или отсутствия исследуемого результата оптимально предусмотреть в исследовании сокрытие информации от исследователя о наличии или отсутствии воздействия причинного фактора в прошлом. В противном случае возрастает вероятность систематической ошибки. Необходимо учитывать вероятное воздействие вмешивающихся неспецифических факторов, наличие которых может исказить данные о связи между технологией и результатом. В исследовании должны быть обозначены контролируемые вмешивающиеся факторы и методы их выявления.
Анализ когортных исследований Основным условием высокого качества когортного исследования является однородность групп на момент начала наблюдения. Группы сравнения не должны существенно различаться по своим характеристикам, за исключением исследуемого фактора (фактора риска, прогностического фактора, изучаемой медицинской технологии). Должны быть описаны метод оценки влияния исследуемого фактора и сила его воздействия. Этот метод должен позволять надежно определить, было или нет воздействие, присутствовал ли фактор риска или прогностический фактор и какова интенсивность этого воздействия. В когортных исследованиях высокого методического качества авторы стремятся определить вероятность наличия изучаемого исхода в группе сравнения на момент начала исследования и учесть возможность влияния подобного фактора на результаты (например, с помощью анализа чувствительности). В когортных исследованиях участники наблюдаются до наступления определенного исхода (события, служащего конечной точкой наблюдения). Исследуемый результат должен быть четко определен, описаны методы и критерии его выявления. Применение слепого метода при выявлении результатов уменьшает вероятность систематической ошибки. Если слепой метод не использовался, в исследовании должен быть обеспечен одинаковый подход к выявлению результатов в группах сравнения. Необходимо учитывать вероятное воздействие вмешивающихся факторов, наличие которых может исказить данные о связи между воздействием и результатом. В исследовании должны быть обозначены контролируемые вмешивающиеся факторы и методы их выявления.
Анализ экспериментальных исследований эффективности медицинской технологии Должен быть описан процесс проведения рандомизации. При отсутствии рандомизации должно быть описано, каким образом формировалась контрольная группа. Отсутствие рандомизации или ее низкое качество не позволяет исключить влияния различий в характеристиках пациентов на результат и существенно повышает вероятность систематической ошибки. Применение слепого метода повышает объективность оценки результатов применения технологии. Чем полнее "ослепление", тем менее вероятность систематической ошибки. При отсутствии рандомизации должны быть описаны все статистически значимые различия между группами в начале наблюдения (как минимум, по полу, возрасту, стадии, тяжести и давности заболевания). Участники в группах должны получать одинаковое лечение, за исключением исследуемой технологии, поскольку применение любой дополнительной технологии является вмешивающимся фактором. Если имели место различия в ведении больных в разных группах, эти различия должны быть описаны и обсуждены. Результаты, которые оценивали авторы, должны быть клинически значимыми, а методы их оценки – известными и достаточно надежными, чтобы подтвердить наличие или отсутствие результата. Клинически значимыми называют результаты, отражающие продолжительность жизни, развитие тяжелых осложнений ("мягкие" и "твердые" конечные точки). Помимо клинически значимых результатов в рандомизированных клинических исследованиях изучаются изменения отдельных клинических характеристик организма (толщины интимы сосудов, концентрации отдельных клеток, концентрации веществ и т.п.) – суррогатные критерии оценки, которые могут быть логически обоснованными признаками прогрессирования или регресса патологического процесса, но обычно не могут заменить клинически важных результатов – "мягких" или "твердых" конечных точек.
Анализ исследований диагностических технологий Оценку эффективности новой диагностической технологии следует проводить путем сравнения ее результатов с результатами известного стандартного метода, применяемого для диагностики изучаемой патологии – референтного теста. В исследовании диагностической технологии должно быть указано, какой референтный тест был использован. Исследователь, проводящий исследование, не должен знать результаты применения метода сравнения (должно использоваться "ослепление"). Референтным методом могут служить результаты нескольких тестов или результаты проспективного наблюдения. Например, если исследуемый новый тест выявляет болезнь на ранней стадии, его результаты могут не совпадать с тем тестом, который используется для диагностики в настоящее время. При этом в проспективном наблюдении развитие болезни у лиц, классифицированных как больные новым тестом, подтвердит правильность его результатов. В исследовании должны быть ясно описаны процедура формирования группы участников и ее характеристики, методика применения исследуемого и референтного методов. Сравнение двух методов (изучаемого и референтного) проводят путем расчета двух показателей: - чувствительности – доли больных, которые определяются диагностическим методом как больные; - специфичности – доли здоровых, которые определяются диагностическим методом как здоровые. В исследовании должна быть приведена информация о том, как была определена граница между нормальными и патологическими результатами референтного и исследуемого методов и как изменение границы нормы и патологии влияет на чувствительность и специфичность метода. Должно быть описано, как интерпретировались промежуточные и неясные результаты диагностического теста (например, как оценивалась голубоватая окраска клеток, если положительным результатом считается синий цвет). В исследованиях высокого методического качества оценивают надежность и воспроизводимость исследуемого метода, обсуждают вероятную прогностическую ценность положительных и отрицательных результатов метода (вероятность болезни у лиц с положительным и отрицательным результатом теста) и его полезность с точки зрения улучшения прогноза лечения.
Систематический обзор и мета-анализ Систематический обзор – метод научного исследования, позволяющий обобщить результаты нескольких клинических исследований на основании заранее спланированных методов. Систематический обзор может являться результатом оценки медицинской технологии. Методическое качество обзора определяется следующими основными положениями. Вопрос, которому посвящен обзор, должен быть четко сформулирован. Должно быть однозначно обозначено, исследования какой медицинской технологии и в какой группе пациентов изучались, и каковы были анализируемые результаты. Обзор должен включать в себя подробное описание методов поиска и оценки качества методики клинических исследований. Методика поиска должна обеспечивать возможно полное выявление работ, посвященных исследуемому вопросу, включая поиск вручную в периодических медицинских изданиях. При систематическом обзоре должна быть проведена оценка качества методики проанализированных исследований и описано, каким образом оценивалось качество (какие критерии были использованы). Из текста обзора должно быть ясно, были ли различия в исследованиях разного методического качества, учтены ли результаты исследований различного методического качества при формировании заключения. В обзоре должны быть приведены данные по эффективности и безопасности технологии (о ее преимуществах и недостатках). Возможно и иное обобщение результатов нескольких исследований с помощью статистического метода – мета-анализа. В мета-анализ, в отличие от систематического обзора, могут быть включены только исследования, сопоставимые по характеристикам участников, использующимся методам, дизайну, оцениваемым результатам. Систематический обзор и мета-анализ при высоком методическом качестве являются источником наиболее достоверных данных.
Интерпретация результатов клинико-экономического анализа Экономичность (экономическая приемлемость) медицинской технологии должна быть обоснована с помощью основных методов клинико-экономического анализа. Оценка экономической целесообразности применения медицинской технологии рабочей группой экспертов может включать в себя как анализ клинико-экономических исследований, обнаруженных в ходе поиска данных о медицинской технологии или дополнительно предоставленных рабочей группе, так и собственное клинико-экономическое исследование, в том числе с применением моделирования. Результаты зарубежных клинико-экономических исследований не могут служить достаточным обоснованием целесообразности применения медицинской технологии в Российской Федерации. При выборе из не связанных между собой и не исключающих друг друга технологий (т.е. технологий, направленных на разные группы населения или на коррекцию разных патологических состояний) результаты клинико-экономического анализа представляются в виде соотношения "затраты/эффект" для каждой из исследуемых альтернатив. Более целесообразной является технология с меньшим соотношением "затраты/эффективность". При этом выбор более целесообразной технологии должен осуществляться в рамках известного фиксированного бюджета, а методика клинико-экономического анализа всех рассматриваемых технологий должна быть идентичной (в частности, анализ затрат должен быть проведен с одной и той же позиции исследования). При выборе между несколькими альтернативными технологиями, использующимися в одной и той же ситуации (или одна, или другая), необходимо ориентироваться на показатель приращения эффективности затрат, рассчитанный по сравнению с альтернативной технологией. Органом по оценке медицинских технологий может быть установлено пороговое значение приращения эффективности затрат. При этом все технологии, имеющие меньшую, чем пороговое значение приращения эффективности затрат, величину, считаются экономически приемлемыми. Для случаев, когда величина приращения эффективности затрат выше порогового значения, могут быть использованы иные подходы для принятия решения о целесообразности применения технологии: гуманистические, профессиональные и иные соображения. В некоторых случаях для принятия решения об экономической приемлемости медицинской технологии используют значение затрат на год сохраненной жизни, годы жизни с поправкой на качество жизни (QALY), годы жизни с поправкой на трудоспособность (DALY). При отсутствии согласованного порогового соотношения затрат и эффекта показатель приращения эффективности затрат для исследуемой технологии может быть сопоставлен с аналогичным показателем для другой технологии, уже применяемой в здравоохранении.
Краткая оценка медицинской технологии В медицинской организации может быть проведена краткая оценка медицинской технологии. Целью проведения краткой оценки является подготовка обоснования для формирования стандартов медицинской помощи в медицинской организации, формулярного перечня лекарственных средств, освоения новых нелекарственных технологий, закупки оборудования, разработки мероприятий по улучшению качества медицинской помощи, повышению квалификации медицинского персонала. При проведении краткой оценки медицинской технологии действенность, эффективность, безопасность и экономическую приемлемость медицинской технологии оценивают на основании преимущественно вторичных источников информации: систематических обзоров, отчетов по оценке медицинских технологий, подготовленных другими организациями, клинических рекомендаций (протоколов лечения), стандартов медицинской помощи, формулярных справочников и пр. Проведение краткой оценки осуществляют в несколько этапов. На первом этапе формируется перечень медицинских технологий для проведения оценки. В данный перечень рекомендуется включать: - технологии, вошедшие в группу А или В при АВС-анализе структуры расходов – и в категорию N – при VEN-анализе (см. приложение Г); - технологии, целесообразность применения которых оценивается неоднозначно различными сотрудниками. Например, технологии, по поводу которых имеются разногласия при работе над стандартами медицинской помощи или формулярным перечнем, проведении экспертизы качества медицинской помощи. При критическом анализе информации о медицинской технологии, представленной в клинических рекомендациях (протоколах лечения), обращается внимание на следующие основные положения: - Все ли основные варианты действий по ведению больных и важные результаты были рассмотрены? - Какие альтернативные медицинские технологии проанализированы? - Был ли прозрачный, понятный и обоснованный процесс поиска, отбора и обобщения доказательств (как и где проводился поиск, когда проводился последний поиск, как было оценено качество исследований, какие исследования были учтены, учитывались ли последние важные достижения науки и практики, включены ли в библиографический список важные исследования)? - Был ли внедрен прозрачный, понятный и обоснованный процесс для оценки значимости различных результатов применения технологии (кто эксперты, как достигался консенсус, учитывалось ли мнение пациентов)? - Удалось ли сформулировать выполнимые клинически значимые рекомендации? - Насколько обоснованны рекомендации (уровень убедительности доказательств)? - Как велика неопределенность, связанная с оценкой доказательств и вынесением суждений? - Кто финансировал работу?
Социальные, правовые и этические аспекты применения медицинской технологии Все клинические исследования (исследования, проводимые с участием человека в качестве субъекта для выявления или подтверждения клинических или фармакологических эффектов исследуемых продуктов, выявления нежелательных реакций на исследуемые продукты, изучения их всасывания, распределения, метаболизма и выведения с целью оценить их безопасность или эффективность) должны быть проведены в соответствии с положениями Хельсинкской декларации и правилами надлежащей клинической практики. Исследования, нарушающие эти принципы и правила, не должны рассматриваться при оценке медицинских технологий. При проведении оценки медицинских технологий необходимо учитывать социальные и этические аспекты применения медицинских технологий, к которым относятся: - приемлемость технологии – ее соответствие принятым в обществе моральным, культурным и религиозным ценностям (примерами медицинских технологий, приемлемость которых различна в разных обществах, являются контрацепция, искусственное прерывание беременности по желанию женщины, переливание крови, использование стволовых клеток в лечебных целях); - соблюдение прав граждан при применении технологии [этические проблемы могут быть связаны с массовым применением технологий в интересах общества, если при этом страдают интересы отдельных граждан (примером такой технологии может служить вакцинация)]; - соблюдение принципа равенства и справедливости в оказании медицинской помощи. Например, внедрение новой дорогостоящей технологии может привести к перераспределению ресурсов здравоохранения и к сокращению финансирования, а значит – к уменьшению доступности других технологий, что может рассматриваться как нарушение принципов равенства и справедливости; - возможность причинения вреда кому-либо в результате применения технологии. Например, результаты генетического обследования могут отрицательно повлиять на семейную жизнь не только самого пациента, но и его близких. При проведении оценки медицинских технологий экспертам следует определить, имеются ли в настоящем и не могут ли возникнуть в будущем серьезные социальные и этические проблемы, связанные с применением медицинской технологии. Для выявления социальных и этических проблем могут быть использованы результаты научных исследований в области психологии, социологии и пр., описывающих ценности общества; исследования, направленные на выявление проблем применения технологий; опросы медицинских специалистов и пациентов; анализ публикаций в средствах массовой информации; личный опыт. При необходимости экспертам следует отразить в рекомендациях этические особенности применения технологии с целью предотвращения, устранения или минимизации возможных социальных и этических проблем. Правовые аспекты оценки медицинской технологии связаны с законодательными или нормативными ограничениями применения технологий. Примерами могут служить применение лекарств вне зарегистрированных показаний, использование клеточных технологий вне экспериментальных исследований и т.д.
Формирование отчета Результаты оценки медицинской технологии оформляют в виде отчета. Рекомендуемая структура отчета об оценке медицинской технологии приведена в приложении Е к ГОСТ Р 56044-2014. Первую редакцию отчета представляют в виде доклада на заседании Органа по оценке медицинских технологий. После доклада Орган по оценке медицинских технологий осуществляет публикацию первой редакции отчета в сети "Интернет" с указанием почтового и электронного адресов для переписки, куда следует направлять замечания и предложения. Должен быть предусмотрен период для открытого обсуждения (не менее одного месяца), в течение которого медицинские специалисты и иные заинтересованные лица могут ознакомиться с первой редакцией отчета и внести свои предложения по изменению отчета, а также представить дополнительные данные об исследуемой медицинской технологии. Орган по оценке медицинских технологий определяет экспертов, которым направляют первую редакцию отчета с предложением представить заключение по отчету. По завершении периода, отведенного на открытое обсуждение, все замечания и предложения сводятся экспертами рабочей группы в таблицу согласования, выносятся предварительные решения по учету предложений и их обоснования (см. табл. 1).
Таблица 1
Форма таблицы согласования замечаний и предложений по проекту отчета об оценке медицинских технологий
На основании предложений готовят окончательную редакцию отчета. Окончательную редакцию отчета и таблицу согласования представляют в виде доклада на заседании Органа по оценке медицинских технологий. Решение об утверждении окончательной версии отчета принимается на основании консенсуса членов Органа по оценке медицинских технологий. Окончательная версия отчета публикуется в периодической печати и в сети Интернет. Распространение отчета осуществляют путем целевой рассылки его бумажной и (или) электронной версии. Все отчеты по ОМТ рекомендуется доводить до сведения органов государственной власти и местного самоуправления в области охраны здоровья, страховых медицинских организаций, фондов обязательного медицинского страхования, руководителей медицинских организаций, ведущих специалистов.
Требования к рекомендациям По результатам оценки медицинских технологий формулируют рекомендации, являющиеся обязательной частью отчета: - по применению медицинской технологии; - по дальнейшему изучению медицинской технологии. Рекомендации по применению медицинской технологии должны включать указание на популяцию людей, в которой рекомендуется (не рекомендуется) применение технологии, и показания к ее применению (здоровые лица определенного возраста, заболевание, синдром, симптом или клиническая ситуация). При необходимости в рекомендации могут быть указаны способ и цель или ожидаемый результат применения медицинской технологии. Для рекомендаций по применению медицинской технологии указывают уровень убедительности доказательств, подтверждающих данную рекомендацию, в соответствии со следующей шкалой: - уровень убедительности доказательств А: доказательства убедительны – существуют веские доказательства в пользу того, чтобы рекомендовать применение технологии; - уровень убедительности доказательств В: относительная убедительность доказательств – существует достаточно доказательств в пользу того, чтобы рекомендовать применение технологии; - уровень убедительности доказательств С: достаточные доказательства отсутствуют – имеющихся доказательств недостаточно для формулирования рекомендации, но рекомендации могут быть даны с учетом иных обстоятельств; - уровень убедительности доказательств D: достаточно отрицательных доказательств – имеется достаточно доказательств для того, чтобы рекомендовать отказаться от применения данной технологии; - уровень убедительности доказательств Е: веские отрицательные доказательства – имеются веские доказательства для того, чтобы рекомендовать отказаться от применения данной технологии. При указании уровня убедительности доказательств, подтверждающих рекомендацию, экспертам следует руководствоваться сведениями, приведенными в табл. 2.
Таблица 2
Соотношение между уровнем убедительности доказательств и особенностями исследований, в которых изучалась технология
Из текста отчета должно быть ясно, что послужило основой для формирования той или иной рекомендации. Рекомендации по дальнейшему изучению медицинской технологии должны определять направления научных исследований для восполнения имеющихся пробелов в знаниях о медицинской технологии. Все рекомендации формируются с учетом правила "Квадрата принятия решения".
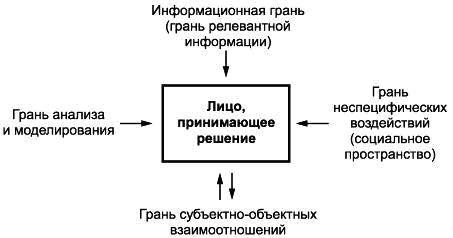
Принятие решений о выборе медицинских технологий на основании правила "Квадрата" Правило подразумевает, что лицо, принимающее решение, испытывает воздействие нескольких различно направленных, иногда взаимоисключающих факторов, условно находясь внутри геометрической фигуры. Эта фигура состоит из четырех граней, образующих в проекции квадрат принятия решения: информационная грань (грань релевантной информации), грань анализа и моделирования, грань неспецифических воздействий, грань субъектно-объектных взаимоотношений (см. рисунок 1). Правило подразумевает несколько последовательных этапов, позволяющих принимать управленческие решения: - первый этап включает поиск релевантной информации (relevant – относящийся к делу), основа принятия решения – информационная грань; - второй этап представляет собой научный анализ информации, построение моделей – грань анализа и моделирования; - третий этап – анализ среды принятия решений – грань неспецифических воздействий (социальное пространство). Условия принятия решения – определенности (лица, принимающие решения, в точности знают результат каждого из альтернативных вариантов выбора), риска (решения, результаты которых не являются определенными, но вероятность каждого результата известна) и неопределенности (невозможно оценить вероятность потенциальных результатов); - четвертый этап заключается в установлении обратной связи – грань субъектно-объектных взаимоотношений. Прогнозирование, измерение и оценка последствий решения или сопоставление фактических результатов с теми, которые лица, принимающие решение, надеялись получить. Устанавливаются возможные ограничения для принятия решений.
Рисунок 1 – Правило принятия решения по выбору медицинских технологий
Актуализация отчета В отчете об оценке медицинской технологии должен быть указан ориентировочный срок его обновления. Период до обновления определяется рабочей группой и согласуется Органом по оценке медицинских технологий, исходя из особенностей медицинской технологии (давность ее применения, наличие незавершенных исследований и пр.). Максимальный срок, по истечении которого отчет должен быть актуализирован, – пять лет со дня публикации. Актуализация отчета может быть проведена в любое время, по решению Органа по оценке медицинских технологий, при появлении новых данных по действенности, эффективности, безопасности и экономичности медицинской технологии. Ответственным за поддержание отчета в актуальном состоянии является экспертный орган по оценке медицинских технологий.
----------------------------------------- Публикация актуальна на 04.06.2019 (дата последней сверки). Источник публикации: журнал «Главный врач». Код публикации: 18.09. Другие статьи по теме | |||||||||||||||||||||
| Категория: Методические материалы | Добавил: zdrav1 (05.06.2019) | |||||||||||||||||||||
| Просмотров: 1168 | |||||||||||||||||||||
| Всего комментариев: 0 | |